Chemie prvků
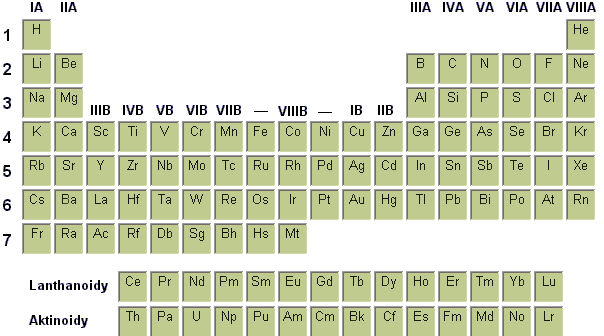
Periodická soustava prvků
-
Popis
- Historie
- Skupiny
- Periody
- Elektronegativita
- Ostatní
Historie
Mendělejevova periodická tabulka prvků nebyla prvním pokusem sestavit prvky podle některých jejich vlastností. Historicky první doloženou tabulku pocházející z roku 1772 vytvořil Louis-Bernard Guyton de Morveau. Zahrnovala chemicky jednoduché látky a použil ji Antoine Lavoisier. Roku 1857 publikoval Jean-Baptiste Dumas základní periodickou tabulku, která obsahovala 32 prvků v osmi sloupcích, které poukazovaly na jejich společné vlastnosti. Roku 1862 uspořádal Alexandre-Emile Béguyer de Chancourtois poprvé prvky podle vzrůstající atomové hmotnosti. Podobné prvky umístil stejným směrem a vytvořil tak šroubovicové uspořádání prvků. Roku 1864 publikoval Lothar Meyer tabulku mocenství pro 49 tehdy známých prvků a ještě v témže roce publikoval také William Odling svou téměř správnou tabulku se 17 svislými sloupci, do které zahrnul 57 prvků. Roku 1869 formuluje Dmitrij Ivanovič Mendělejev periodický zákon a různé formy periodické tabulky, která obsahovala 63 prvků. O dva roky později Mendělejev upravil a zlepšil svou periodickou tabulku a předpověděl objev 10 prvků - dnes známé jako Sc, Ga, Ge, Tc, Re, Po, Fr, Ra, Ac a Pd. Z těchto prvků popsal s udivující předvídavostí skandium, gallium, germanium a polonium. Pro neobjevené prvky nechal Mendělejev v tabulce místo a postupem času se všechna volná místa, která v tabulce nechal, zaplnila nově objevenými prvky.
Periody
V periodickém systému rozumíme pod pojmem periody jednotlivé řádky v periodické tabulce. V rámci periody se vlastnosti prvků mění, nejsou podobné. Zleva doprava obecně roste hmotnost atomu, rovněž tak roste i elektronegativita. Prvky zcela vlevo a uprostřed mají kovový charakter, prvky na konci periody jsou polokovy a nekovy. Jednotlivé periody značíme arabskými číslicemi 1 - 7. Lanthanoidy ani aktinoidy nenáleží do žádné další periody. Z periodické tabulky se vyjímají pouze pro větší přehlednost. Lanthanoidy náleží do 6. periody za lanthan a aktinoidy do 7. periody za aktinium.
Skupiny
V periodickém systému rozumíme pod pojmem skupiny jednotlivé sloupce v periodické tabulce. Ve skupině se pod sebou nacházejí ve sloupcích nacházejí prvky s podobnými vlastnostmi. To je způsobeno tím, že tyto prvky mají podobně uspořádanou valenční sféru a tedy i podobnou elektronovou konfiguraci. Jednotlivé skupiny značíme arabskými číslicemi 1 - 18. Staré značení využívající římských číslic I - VIII a písmen A (pro hlavní skupiny) a písmen B (pro vedlejší skupiny) již pokud možno nepoužíváme.
Elektronegativita
Elektronegativita je schopnost atomu přitahovat vazebné elektrony (elektrony účastnící se vazby). Elektronegativnéjší atom (ten s vyšší X) ve vazbě k bobě poutá elektronový pár silněji než druhý elektropozitivnější atom. Za základ stupnice elektronegativit byla zvolena X vodíku (X = 2,15). Nejnižší elektronegativitu mají alkalické kovy a nejvyšší halogeny. Elektronegativita prvků obecně roste z levého dolního rohu do pravého horního rohu periodické tabulky. Nejnižší elektronegativitu má cesium (0,79), resp. radioaktivní francium (0,7) a nejvyšší pak fluor (3,98). Hodnoty elektronegativit prvků jsou v přímé souvislosti s jejich chemickým chováním. Kovy, které jsou v levé části periodického systému, snadno ztrácejí elektron a ochotně tvoří kationty. Jejich elektronegativita je proto logicky nízká. Naopak v pravé části periodické tabulky nalézáme prvky nekovové, které velice ochotně elektrony přijímají a tvoří proto záporně nabité ionty. Ty prvky proto mají elektronegativitu vysokou.
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Etiam lectus nulla, fermentum et, tristique et, consequat in, ligula.